
周期律表において、このような化学元素は、ヒ素として、それは金属 - 非金属境界上の位置を占める。その活性によって、それは水素と銅との間に位置する。非金属的性質は、-3の酸化状態(AsH3 - アルシン)。正の酸化状態+3を有する化合物は両性特性を有し、+ 5度でその酸性特性が現れる。ヒ素酸化物とは何ですか?

以下のヒ素酸化物がある:As2〜について3 As2〜について5。対応する水酸化物もある:

ヒ素は2つの酸化物を形成し、そのうちAs2〜について3 三酸化物と呼ばれる。それはしばしば治療に使用される物質ですが、無害な化学物質ではありません。これは無機化合物であり、有機ヒ素化合物(炭素との化学結合を含む化合物)および他の多くのものの主な供給源である。 Asの多くのアプリケーション2〜について3 要素の毒性のために、この化合物の商品名はトリセノックスである。
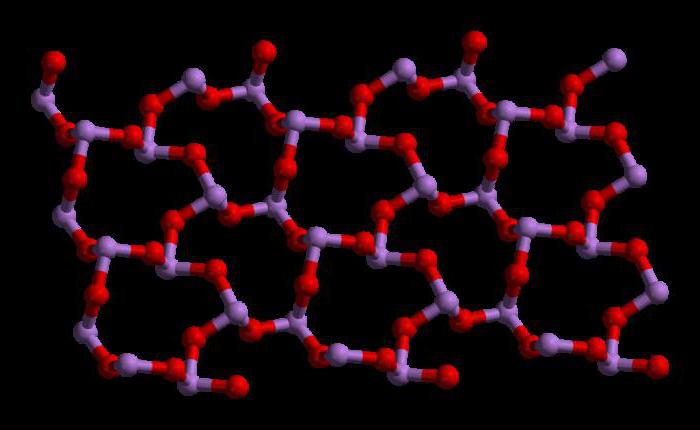
三酸化二ヒ素の化学式は次のような形をとる。2〜について3。この化合物の分子量は197.841g / mol。この酸化物を作る方法はたくさんあります。その一つが硫化物鉱石の焙焼です。化学反応は以下の通りです。
2As2〜について3 + 902 →2As2〜について3 + 6SO2
ほとんどの酸化物は他の鉱石処理の副産物として。砒素鉄鉱は金や銅によく見られる不純物であり、空気の存在下で加熱すると三酸化砒素を放出します。これは深刻な中毒につながる可能性があります。

三酸化ヒ素は、式Asを有する。4O6 液相および気相中(800℃以下)。これらの相では、それは三酸化リン(P4O6)しかし、800℃を超える温度で4O6 分子のAsに分解2O3。この段階では、ジイソトロントリオキシド(N2O3)その固体状態では、この化合物は多形能力(結晶構造の2つ以上の形態で存在する能力)を示す。

三酸化ヒ素の主な特性は次のとおりです。
この化学薬品はクラスに属します抗腫瘍剤と癌の治療に使用されます。ヒ素毒性はよく知られています。しかし、三酸化ヒ素は化学療法薬であり、特定の種類の癌の治療に長年使用されてきました。この治療に使用される溶液はファウラー溶液と呼ばれます。 1878年に、ボストンシティ病院はこの解決策が人間の白血球数を減らすのに効果的であるかもしれないと報告しました。
その結果、2O3 主に治療に使用された白血病は放射線療法に置き換えられるまで。しかし、1930年代以降、彼は現代の化学療法が登場するまで、白血病の治療で徐々に人気を取り戻しました。この酸化ヒ素は慢性骨髄性白血病のための最良の治療法と考えられていました。今日でも、この物質は、失敗したレチノイドまたはアントラサイクリン化学療法による特定の種類の急性前骨髄球性白血病の治療に使用されています。慢性骨髄性白血病、多発性骨髄腫、急性骨髄性白血病、リンパ腫、リンパ系のがんの治療にも使用されます。

三酸化ヒ素はで広く利用されています無色のガラスの製造この化合物は、半導体や一部の合金を製造するための電子機器にも役立ちます。塗料に使用されています。三酸化ヒ素は脳腫瘍のための効果的な治療法になります。
過去にこの物質は歯科に使用されていましたが、それは非常に有毒な化合物であるため、現代の歯科医によるその使用は中止されました。酸化ヒ素(式As2O3)も木材防腐剤として使用されていますが、そのような材料は世界の多くの地域で禁止されています。酢酸銅と組み合わせると、三酸化ヒ素は明るい緑色の顔料を生成します。
三酸化物自体は高い毒性したがって、それを使用する前に常に必要な予防措置を講じる必要があります。次のような場合には非常に危険です。

この物質の一般的な副作用には、次のような症状があります。
あまり一般的ではない副作用は次のとおりです。
副作用として珍しい2O3:
三酸化ヒ素の生命を脅かす症状は、体重増加、発熱、呼吸困難、息切れ、胸痛、咳です。
三酸化ヒ素は非常に有毒です。人の死にさえつながる可能性のある物質。しかしながら、それは医療分野においてその有用性を有する。常に注意を払うべきです。
三酸化ヒ素は両性です高級酸化ヒ素、およびその水溶液は弱酸性です。従って、それはアルカリ性溶液に容易に溶解して砒酸塩を得る。それは塩酸を除いて酸に溶けにくいです。
オゾン、過酸化水素、硝酸などの強力な酸化剤でのみ、ある程度の酸性度を持つ五酸化ヒ素を生成します。2O5。耐酸化性に関しては、三酸化ヒ素は五酸化リンに容易に燃える三酸化リンとは異なります。還元により元素状ヒ素またはアルシン(AsH)が得られる3)。

五酸化物の化学式はAsです。2O5。そのモル質量は229.8402g / molである。密度4.32 g / cmの白い吸湿性粉末です。3。融点が315℃に達するそれは分解し始めます。物質は水とアルコールによく溶けます。酸化ヒ素の特性はそれを環境に対して非常に有毒で危険にします。あまり一般的ではないこの無機化合物は、非常に有毒であり、それ故、高級砒素酸化物(式As)とは異なり、商業用途は限られている。2O3)。
ヒ素は主に毒として知られています発がん性その三酸化物は無色、無味、無臭の溶液を生成する水溶性の粉末です。それは中世で殺害の一般的な方法でした。その使用は今日でも続いていますが、平和的な目的のためにそして少量であります。
